Tumorstoffwechsel
Die Tumorentstehung ist bei Mensch und Tier mit einschneidenden Veränderungen im Zellstoffwechsel verbunden. Dabei kommt es unabhängig von der Stoffwechsellage des Ursprungsgewebes, aus dem der Tumor hervorgegangen ist, wie z.B. Leber oder Gehirn bei bestimmten Stoffwechsel-Parametern immer zur Ausprägung desgleichen Phänotyps. Der Tumor-spezifische Stoffwechsel-Phänotyp wird als Tumor-Metabolom bezeichnet.
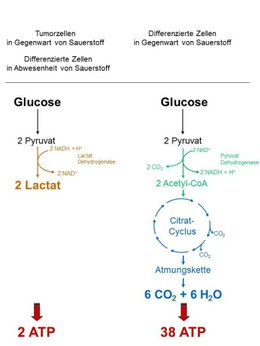
Abb. 1
Eines der Tumor-spezifischen Stoffwechsel-Merkmale ist die vermehrte Umsetzung von Glucose zu Milchsäure (Lactat) in Gegenwart von Sauerstoff, die zum ersten Mal von Otto Heinrich Warburg im Jahre 1924 beschrieben wurde und als „Warburg-Effekt“ in die Literatur eingegangen ist. Differenzierte Gewebe, wie z.B. der Muskel beschreiten diesen Weg der Energiegewinnung in der Regel nur im Sauerstoffmangel. In Gegenwart von Sauerstoff verstoffwechseln differenzierte Gewebe die Glucose über die Glycolyse, den Citratzyklus und die Endoxidation zu CO2 und Wasser und gewinnen dabei pro Mol Glucose 38 Mole ATP (Abb. 1). Demgegenüber liefert die Umsetzung von Glucose zu Lactat nur 2 Mole ATP. Diese offenbare Verschwendung von Energie veranlasste Otto Warburg zu der Hypothese, dass in Tumorzellen ein Defekt in der mitochondrialen Atmung die Ursache für die vermehrte Lactat-Produktion in Gegenwart von Sauerstoff sein müsse.
Die Forschungsergebnisse anderer Arbeitsgruppen und unsere eigenen Metabolom-Analysen zeigten, dass Tumorzellen neben Glucose die Aminosäure Glutamin als zweite wichtige Energiequelle erschließen. Der Energie-lieferende Abbau von Glutamin wird Glutaminolyse genannt und rekrutiert Reaktionsschritte des Citratzyklus und der mitochondrialen Endoxidation (Abb. 2, siehe unten). Die mitochondriale Energiegewinnung kann folglich nicht vollständig defekt sein. Es stellt sich daher weiterhin die Frage, warum Tumorzellen durch eine hohe Glycolyse-Umsatzrate ausgezeichnet sind.
Unsere Stoffwechsel-Charakterisierungen einer Vielzahl von verschiedenen Tumorzelllinien und soliden Tumoren haben gezeigt, dass neben der Regenerierung von Energie die Bereitstellung von Zellbausteinen, wie Nukleinsäuren, Phospholipiden und Aminosäuren eine wesentliche Aufgabe des Tumor-Stoffwechsels ist. Nukleinsäuren werden zum Beispiel für die DNA-Synthese, Phospholipide für den Aufbau der Zellmembranen und Aminosäuren für die Synthese wichtiger Proteine der Tochterzellen benötigt. Für die Synthese dieser Zellbausteine sind Zwischenprodukte der Glycolyse wichtige Ausgangsstoffe. Diese Stoffwechsel-Funktion haben wir als metabolic budget system bezeichnet. Nur wenn ein genügend hohes Budget an Stoffwechsel-Zwischenprodukten sowohl für die Regenerierung von Energie als auch zur Synthese von Zellbausteinen zur Verfügung steht und optimal auf diese beiden Aufgaben verteilt wird, können Zellteilungen erfolgreich durchgeführt werden.
Ein wichtiger Regulator des metabolic budget system ist das Glycolyse-Enzym Pyruvatkinase. In Abhängigkeit der unterschiedlichen Stoffwechselaufgaben der verschiedenen Gewebe werden verschiedene Isoenzyme der Pyruvatkinase exprimiert, die sich in ihren Aminosäure-Sequenzen, ihren kinetischen Eigenschaften und ihren Regulationsmechanismen markant unterscheiden. Während der Tumorentstehung verschwindet das Gewebe-spezifische Pyruvatkinase-Isoenzym und das Isoenzym Typ M2 (Abkürzung: M2-PK oder PKM2) wird überexprimiert.
Unsere Proteom- und Metabolom-Analysen haben gezeigt, dass die Quartärstruktur (Tetramer : Dimer-Verhältnis) der PKM2 entscheidend das Stoffwechselgeschehen in den Tumorzellen reguliert. Wir konnten verschiedene Oncoproteine – dies sind die Produkte von Krebs-induzierendenen Oncogenen – identifizieren, die einen Zerfall des tetrameren Enzyms in eine wenig aktive dimere Form induzieren. Aufgrund der Oncoprotein-induzierten Inaktivierung der PKM2 kommt es zu einem Anstau aller Glycolyse-Zwischenprodukte oberhalb der Pyruvatkinase-Reaktion, die in der Folge in genügend hohen Konzentrationen für die Synthese der notwendigen Zellbausteine zur Verfügung stehen. Allerdings ist das Tetramer : Dimer-Verhältnis der PKM2 kein starres Verhältnis. Bestimmte Zwischenprodukte des Stoffwechsels, wie der Signalmetabolit Fructose 1,6-P2, können die vorrübergehende Reassoziation des Enzyms zur aktiven tetrameren Form induzieren (Abb. 3, siehe unten). Der Fructose 1,6-P2 geregelte Wechsel zwischen der hochaktiven tetrameren Form und der wenig aktiven dimeren Form der PKM2 ermöglicht den Tumorzellen eine optimale Anpassung ihres Stoffwechsels an variierende Nährstoffbedingungen, wie z.B. Glucosemangel.
In Tumoren überwiegt kraft der Oncoproteine die inaktive dimere Form der M2-PK. Sie wird von den Tumoren ins Blut und von gastrointestinalen Tumoren ebenfalls in den Stuhl abgegeben. Die Quantifizierung der M2-PK im Plasma und Stuhl wird erfolgreich zur Diagnose von Tumorerkrankungen und für Verlaufskontrollen unter der Therapie beim Menschen angewendet.
Daneben ist die PKM2 ein interessanter Angriffspunkt für therapeutische Ansätze. Wir konnten Peptid-Aptamere identifizieren – dies sind kurze Peptidsequenzen von 10 - 20 Aminosäuren, die an ein Stützprotein gebunden sind – die spezifisch an die PKM2, nicht aber an das zu 96 % homologe M1-PK-Isoenzym binden und die Feinregulation des Tetramer : Dimer-Verhältnisses der PKM2 unterbinden. Die Peptid-Aptamere führen in Abhängigkeit vom Nährstoffangebot der Zellen (Glucose, Glutamin, Sauerstoff) zu einer Hemmung oder Aktivierung der Proliferation (Zellteilung) von Tumorzellen.
Unsere Ergebnisse zeigen, dass das Wissen über die Tumor-spezifischen Stoffwechsel-Eigenschaften vielversprechende Möglichkeiten zur frühzeitigen Erkennung von Tumoren, zur Prognose von therapeutischen Ansätzen sowie zur Entwicklung von neuen Therapiekonzepten eröffnet.
Kooperationspartner:
Marta Cascante, Universitat de Barcelona, Spain
Brian R. Davidson, Royal Free and University College Medical School, London UK.
Colin Collins, Prostate Cancer Center, University of Vancouver, BC
Hannes Drexler, Max-Planck-Institut für Molekulare Biomedizin, Münster
Pidder Jansen-Dürr, Österreichische Akademie der Wissenschaften, Innsbruck.
Robert Friis, Universität Bern, Schweiz
Matthias Engel, Universität des Saarlandes, Homburg.
Helmut Grimm, Klinikum Passau
Ulf Rapp, Universität Würzburg
Frank Rösl, DKFZ Heidelberg
José Rosa, Universitat de Barcelona, Spain
ScheBo Biotech AG
Pablo Steinberg, Tierärztlichen Hochschule Hannover
Jakob Troppmair, Universität Innsbruck.
Peter Vaupel, Universität Mainz.
Werner Zwerschke, Universität Innsbruck.
