AG Fugmann

Bildrechte: privat
Prof. Dr. Tim Fugmann hat Technische Biologie an der Universität Stuttgart studiert und später an der ETH Zürich zum Thema "Innovative Methoden für die proteomische Entdeckung von vaskulären Markern bei Krebs und Nierenerkrankungen" promoviert. Nach der Promotion wechselte er zur Philochem AG als Leiter der Target Discovery mit der Aufgabe, neue Ziele für pharmazeutische Interventionen zu entdecken. Um besser zu verstehen, warum bestimmte Patienten auf Immuntherapien ansprechen, implementierte seine Gruppe modernste HLA-Peptidom-Technologien zur Untersuchung der Interaktionen zwischen T-Zellen und Krebszellen. Nach neun Jahren in der Industrie wechselte er nach Berlin an das Max-Delbrück-Centrum für Molekulare Medizin, um TCR-T-Zell-Therapeutika aus der akademischen Forschung in klinische Studien zu bringen. Im Februar 2021 wurde er zum Professor für Proteomik mit Schwerpunkt Massenspektrometrie an der JLU Gießen ernannt. Die Gruppe arbeitete mit dem hochmodernen Orbitrap Fusion Eclipse Massenspektrometer. Im August 2022 verließ Dr. Tim Fugmann die Justus-Liebig-Universität und damit auch unser Institut.
Forschungsschwerpunkte der AG Fugmann:
1) Präzisionsmedizin bei Lungenkrebs und Autoimmunerkrankungen
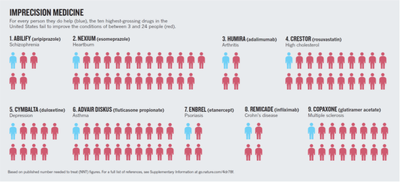
Ungeachtet des hohen Preises, der mit neuen Therapeutika verbunden ist, profitieren nur etwa 10-40% der Patienten von der Therapie (siehe Abbildung 1). Einer der Gründe dafür ist, dass derzeit alle Patienten eines bestimmten Krankheits-Stadiums mit demselben Medikament behandelt werden. Wie wir jedoch wissen, dass jeder Mensch eine einzigartige genetische und epigenetische Ausstattung hat, und Unterschiede in Verträglichkeit und Effektivität der Medikamente führt.
Die Lösung ist eine patientenzentrierte Behandlung, bei der jeder Patient die optimale Therapie erhält, die zum bestmöglichen Ergebnis führt. Dies erspart den Patienten unnötige Behandlungen (und die damit verbundenen Nebenwirkungen) und verringert die Belastung für Patienten, aber auch die Kosten des Gesundheitswesens. Eine solche patientenzentrierte Behandlung erfordert Strategien der Präzisionsmedizin, bei denen Patienten genau diagnostiziert und in eine Untergruppe/einen Phänotyp eingeteilt werden, die/der mit dem Ansprechen auf bestimmte Behandlungen in Verbindung steht.
Während für einige wenige Krankheiten genetische oder proteomische Marker für Patientenuntergruppen bekannt sind (Her2-positiver vs. ER-positiver vs. dreifach negativer Brustkrebs), sind wir bei den meisten Indikationen noch sehr weit von einer auf Biomarker ausgerichteten Behandlung entfernt. Die AG Fugmann hat sich zum Ziel gesetzt, die Charakterisierung des einzelnen Patienten mit proteomischen Technologien zu unterstützen, um die Präzisionstherapie von Lungenkrebs und Autoimmunerkrankungen zu erleichtern. Zwei Technologien, die eingesetzt werden, um Anwendungen der Präzisionsmedizin zu erleichtern, werden in 2) und 3) beschrieben.
Bildrechte: privat
Abbildung 1: Die Notwendigkeit einer Präzisionsmedizin. Wenn alle Patienten mit demselben Medikament behandelt werden (derzeitige Strategie), profitieren nur 4-24 % der Patienten von der Behandlung. In Zeiten, in denen Therapien immer teurer werden, sind erhebliche Gesundheitskosten mit einer unwirksamen Behandlung verbunden. (angepasst aus Schork, N.J. (2015) Nature, 520, 611)
2) Charakterisierung der HLA-präsentierten Peptiden
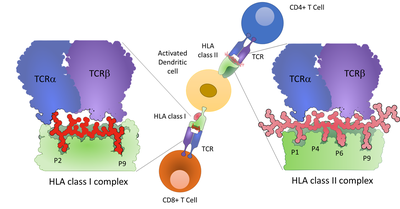
Adaptive Immunprozesse werden durch die Interaktion von T-Zellen mit der Zielzelle durch Bindung des T-Zell-Rezeptors an Peptide vermittelt, die auf MHC-Komplexen (Major Histocompatibility Complex; im Menschen auch HLA) präsentiert werden (siehe Abbildung 2).
Bildrechte: privat
Abbildung 2: Präsentation von Peptiden auf HLA-Klasse-I- und HLA-Klasse-II-Komplexen auf einer dendritischen Zelle. CD8+ T-Zellen können mit HLA-Klasse-I-Molekülen interagieren, während CD4+ T-Zellen mit HLA-Klasse-II-Komplexen interagieren. Die molekulare Interaktion von HLA, Peptid und T-Zell-Rezeptor ist dargestellt, wobei das Bindungsregister des Peptids an das HLA-Grundgerüst hervorgehoben wird.
Nachdem die intakten HLA-Komplexe mit Antikörpern aufgereinigt wurden können mit modernsten Methoden und Instrumenten Tausende von HLA-präsentierten Peptiden identifiziert werden, die das Immunopeptidom von Geweben oder kultivierten Zellen definieren (HLA-Peptidomik; siehe Abbildung 2). Die Technologie ist in der AG Fugmann etabliert und wurde bereits auf Organe, Blut und kultivierten Zellen angewandt. Die AG Fugmann ist daran interessiert, empfindlichere und reproduzierbare Methoden zu entwickeln, um ein umfassenderes Profil des HLA-Peptidoms zu erstellen und gleichzeitig den Nachweis und die Quantifizierung von krankheitsrelevanten Antigenen zu erleichtern.
Bildrechte: privat
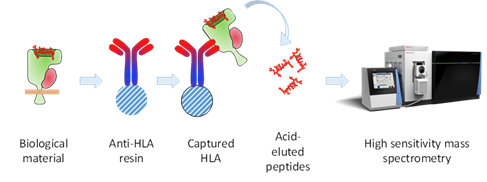
Abbildung 3. Das Verfahren zur Identifizierung von Haupt-Histokompatibilitäts-Antigenen (MHC) [beim Menschen Humanes Leukozyten-Antigen oder HLA genannt], die Peptide aus Krebszellen darstellen (HLA-Peptidomik). Krebszellen oder Gewebe werden lysiert und die HLA-Peptidkomplexe werden mit hochaffinen Anti-HLA-Antikörpern gereinigt. Nach gründlichem Waschen werden die Peptide in Säure eluiert, weiter gereinigt und schließlich einer hochauflösenden Massenspektrometrie unterzogen. Mit den in der Literatur beschriebenen Antikörpern können die verschiedenen MHC-Komplexe (Klasse I, Klasse II, Maus, Mensch) gereinigt werden (Purcell, T., et al. (2019) NatProtocols, 14, 1687).
3) Charakterisierung der extrazellulären Matrix und des Zelloberflächenproteoms zur Untersuchung pathologischer Prozesse
Insbesondere in der extrazellulären Umgebung des Tumors spielen die Interaktionen zwischen Tumorzellen, Immunzellen, Fibroblasten und der extrazellulären Matrix eine wichtige Rolle bei der Modulation des Immunsystems des Patienten, was das Tumorwachstum und die Therapieresistenz begünstigen kann. Auf der anderen Seite gibt es mehrere therapeutische Optionen, die auf die Mikroumgebung des Tumors abzielen und Prozesse wie die Proteaseaktivität modulieren oder entzündungshemmende Mediatoren blockieren. Für eine erfolgreiche Behandlung von Krebserkrankungen, wie z.B. Lungenkrebs, ist es wichtig, die extrazelluläre Landschaft der pro- und anti-inflammatorischen Faktoren zu verstehen. Die AG Fugmann verfügt über umfangreiche Erfahrung in der proteomischen Charakterisierung von extrazellulären Matrixproteinen und Zelloberflächenmarkern durch in vivo, in vitro, ex vivo Biotinylierung und Auftrennung mittels Detergenzien. Die Ergebnisse können zur Kartierung von Zelltypen, Proteasen und Immunmodulatoren verwendet werden, um therapeutische Entscheidungen zu treffen.
Publikationen finden Sie in PubMed.