AG Schmitz

Bilderrechte: privat
Einleitung
Unsere Gruppe untersucht die molekularen Mechanismen, welche für die Auswirkungen von Signalkaskaden auf die Dynamik der Genexpression und der Chromatinorganisation verantwortlich sind. Wir untersuchen diese Prozesse anhand des NF-κB-Transkriptionsfaktorsystems und der Familie der stressregulierten Homeodomain-interacting-Protein-Kinasen (HIPKs) als Modellsysteme. Wir untersuchen, wie externe Signale zur Aktivierung von Proteinkinasen führen, die dann ihre Signale in den Zellkern weiterleiten, wo sie Transkriptionsfaktoren und epigenetische Ereignisse regulieren. Für diese Studien verwenden wir eine Vielzahl von biochemischen und zellbiologischen in-vitro- und in-vivo-Methoden, ziehen aber auch klinische Proben und Modellorganismen zur Validierung unserer Erkenntnisse heran. Die Signalübertragungssysteme NF-κB und HIPK sind wichtige Regulatoren der Stressreaktion und der Zellproliferation und werden daher bei einer Vielzahl von proliferativen Krankheiten wie Krebs oder Fibrose dysreguliert. Wir sind immer an Bewerbungen von angehenden Doktoranden oder Postdocs interessiert, die bereit sind, sich einem kompetitiven Team mit guter Atmosphäre anzuschließen.
Bildrechte: privat
Forschung
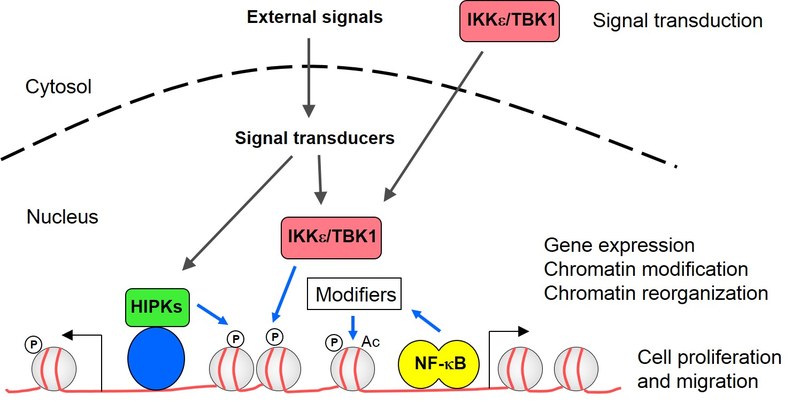
1) Der erste Schwerpunkt unserer Forschung liegt auf NF-κB. Dieser Transkriptionsfaktor trägt zum Aufbau einer wirksamen Immunantwort bei, ist aber auch an der Regulierung von Zellmigration, -proliferation und -apoptose beteiligt. Die Beteiligung von NF-κB an zentralen biologischen Prozessen und seine außergewöhnliche Konnektivität mit anderen Signalwegen machen eine hochgradig kontrollierte Regulierung der NF-κB-Aktivität auf mehreren Ebenen erforderlich. Die so genannten nicht-kanonischen IKK-Kinasen IKKε und TBK1 haben die Aufgabe, die Aktivität verschiedener proinflammatorischer Transkriptionsfaktoren auszulösen, darunter die NF-κB-Untereinheit p65 und IRFs. Die Analyse der nicht-kanonischen IKKs und ihrer Adaptorproteine ist für das Labor von besonderer Bedeutung, da ihre Überexpression unter pathophysiologischen Bedingungen die onkogene Transformation von Brustkrebszellen auslöst und die Chemoresistenz von nicht-kleinzelligem Lungenkrebs und HER2+ Brustkrebszellen vermittelt. Mechanistisch gesehen löst die Überexpression der nicht-kanonischen IKKs die Expression anti-apoptotischer Signale aus, stimuliert die Zellproliferation und ermöglicht auch die PI3K-unabhängige direkte Phosphorylierung der überlebensfördernden Kinase AKT. Darüber hinaus ermöglicht die konstitutive Aktivität der nicht-kanonischen IKKs autokrine Zytokinkreisläufe, die das Wachstum und die Migration von Tumorzellen fördern.
Die NF-κB-Aktivität wird auch innerhalb des Zellkerns reguliert. In Zusammenarbeit mit der Gruppe von Michael Kracht (Gießen) nutzen wir genomweite Analysen, um den Beitrag von Kofaktoren und vorgeschalteten Kinasen für die Chromatin-Rekrutierung von NF-κB p65 und die Chromatin-Modifikation zu klären. Außerdem untersuchen wir die genomweite Rekrutierung von posttranslational modifiziertem NF-κB p65 und einer DNA-bindenden Mutante, um ihre physiologische Funktion für die Transkriptionsaktivierung und Chromatinassoziation aufzudecken. Wir testen die funktionellen Konsequenzen eines stimulusinduzierten Konformationswechsels von NF-κB p65 unter Verwendung eines kürzlich identifizierten konformationsspezifischen Antikörpers. Diese Experimente werden Rückschlüsse auf die Bedeutung der posttranslationalen Modifikationen, der kontextspezifischen Konformation und der DNA-Bindung für die Funktionen von p65 erlauben und ein besseres Verständnis der molekularen Mechanismen ermöglichen, die der Plastizität der NF-κB-abhängigen Genregulation in gesunden und kranken Zellen zugrunde liegen.
2) Der zweite Schwerpunkt liegt auf der HIPK-Familie der Serin/Threonin-Kinasen. Sie fungieren als Integratoren für eine Vielzahl von Stresssignalen. Eine Reihe von Bedingungen, die prekäre Situationen darstellen, wie z. B. DNA-Schäden, Hypoxie, reaktive Sauerstoffzwischenprodukte und metabolischer Stress, beeinflussen die Funktion der HIPKs. Die Kinasen fungieren als Integratoren für diese Stresssignale und leiten sie in viele verschiedene nachgeschaltete Effektorwege ein, die zur Bewältigung dieser prekären Situationen dienen. Ihre zentrale Rolle als Signalknotenpunkte mit der Fähigkeit, viele nachgeschaltete Effektorwege zu formen, bringt sie häufig in proliferative Krankheiten wie Krebs oder Fibrose ein. Mit genomweiten Assays untersuchen wir, wie HIPKs an bestimmten Stellen im Genom verankert sind und wie sie die Genexpression umprogrammieren. Wir haben mit Hilfe von ChIP-Seq Chromatin-Bindungsstellen für ein Mitglied der HIPK-Familie identifiziert und festgestellt, dass die Mehrzahl der Bindungsmotive mit einer Sequenz überlappt, die von einem ubiquitär exprimierten Transkriptionsfaktor erkannt wird. Der relative Beitrag dieses Transkriptionsfaktors zur Chromatinbindung der Kinase und die funktionelle Bedeutung für die HIPK-regulierte Genexpression und die Veränderung benachbarter Chromatinregionen werden derzeit untersucht. Wir untersuchen auch den Beitrag dieser Kinasen zur Kopplung von Transkriptionsinitiierung, Elongation und Weiterverarbeitung/Degradation der entstehenden Transkripte. Dies ist von besonderer Bedeutung bei bestimmten Hirntumoren, die von der konstitutiven Aktivität der HIPKs abhängig sind. Da Kinasen durch kleine Moleküle gehemmt werden können, ist die Entwicklung von spezifischen und reversiblen HIPK-Inhibitoren ein weiteres Ziel des Labors.

Bildrechte: wordcloud.com
Quantitative Darstellung der Wörter, die in den Abstracts unserer Veröffentlichungen der letzten 10 Jahre enthalten sind.
Eine Liste der Publikationen finden Sie unter PubMed.
An diesen Forschungsverbünden sind wir beteiligt: SENESCENCE2030 - CA23119, CPI, GRK2573/2
Eine Liste unserer Alumni finden Sie hier.
Kontaktdaten zu den Mitarbeitenden der Gruppe finden Sie hier.
