AG Lochnit - Andere Modellsysteme
Ascaris suum, ein Darmparasit
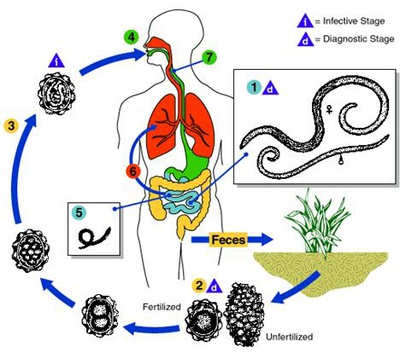
Über den taxonomischen Status von Ascaris lumbricoides beim Menschen und Ascaris suum beim Schwein ist viel diskutiert worden. Die Rasterelektronenmikroskopie und biochemische Untersuchungen haben schließlich ergeben, dass es sich um zwei verschiedene Arten handelt, nämlich A. lumbricoides und A. suum. Aufgrund ihrer engen Verwandtschaft werden sie als Geschwisterarten betrachtet (1). Der Parasit zeigt einen einfachen Lebenszyklus (2). Die Eier werden mit dem Kot ausgeschieden, wobei sich die infektiösen Larven innerhalb von 9-13 Tagen entwickeln. Nachdem die Eier verschluckt wurden, schlüpfen die Larven im Zwölffingerdarm. Die L2-Larven bohren sich in die Schleimhaut, dringen in die Blutgefäße ein und erscheinen nach 6 Stunden in der Leber. In der Leber entwickeln sie sich innerhalb weniger Tage zum L3-Stadium. Danach wandern sie in das Herz und die Lunge. Nach sieben Tagen brechen sie in die Lungenbläschen ein und gelangen über die Luftröhre in den Darm, wo sie sich erneut häuten, das Erwachsenenalter erreichen, sich paaren und Eier produzieren.
Ascaris wird aufgrund seiner Größe (Weibchen 200-350 nm, Männchen 150-310 mm) seit Jahrzehnten als prototypischer Nematodenmodellorganismus für biochemische und neurophysiologische Studien verwendet. Da große Mengen von Würmern im Schlachthof gewonnen werden können, ist die Isolierung von Biomolekülen leicht möglich. Die In-vitro-Kultivierung adulter Nematoden ist möglich, und es wurde auch über die Erzeugung früher adulter Tiere aus Eiern in vitro berichtet (3-5). Aufgrund seiner Größe und seiner gut bekannten Anatomie ist dieser Fadenwurm ein hervorragendes Modell für Immunfluoreszenz- und immunhistochemische Untersuchungen.
Bildrechte: privat
Acanthocheilonema viteae, ein Modell für Filariose
Aufgrund der Probleme bei der Kultivierung menschlicher Filariiden wie Onchocerca volvulus oder Wuchereria bancrofti in Tiermodellen ist A. viteae, ein Nagetierfilariid, zu einem der am meisten untersuchten Modellsysteme für Filariose geworden (6,7). A. viteae enthält PC-substituierte Antigene, die denen der menschlichen Filariden ähneln (8-10). Die adulten Tiere können tagelang in Zellkulturmedium gehalten werden, so dass Stoffwechselstudien möglich sind. Der Eichelhäher, Meriones libycus, wird in der Regel durch subkutane Injektion von L3-Larven aus der Zecke Ornithodorus moubata infiziert. Mikrofilarien erscheinen im Blutkreislauf nach 42-65 Tagen nach der Infektion. Die Zecken wurden infiziert, indem man sie an den rasierten Bäuchen von betäubten Vögeln fressen ließ. Nach zwei Häutungen entwickeln sie sich innerhalb von 6 Wochen zum infektiösen Stadium.
Literatur:
1. Nadler, S. A. (1987) Journal of Parasitology 73, 811-816
2. Crompton, D. W. T. (1989) in Ascaris and its prevention and control (Crompton, D. W. T., Nesheim, M. C., and Pawlowski, Z. S., eds), pp. 9-44, Taylor & Francis, London
3. Levine, H. S., and Silverman, P. H. (1969) J. Parasitol. 55, 17-21
4. Douvres, F. W., and Urban, J. F. (1983) J. Parasitol. 69, 549-558
5. Douvres, F. W., and Urban, J. F. (1986) Proc. Helminthol. Soc. Wash. 53, 256-262
6. Worms, M. J., Terry, R. J., and Terry, A. (1961) Journal of Parasitology 47, 963-970
7. Eisenbeiss, W. F., Apfel, H., and Meyer, T. F. (1991) J Parasitol 77, 580-586
8. Gualzata, M., Weiss, N., and Heusser, C. H. (1986) Exp. Parasitol. 61, 95-102
9. Gualzata, M. D., Rudin, W., Weiss, N., and Heusser, C. H. (1988) Parasite Immunol. 10, 481-491
10. Harnett, W., Worms, M. J., Kapil, A., Grainger, M., and Parkhouse, R. M. E. (1989) Parasitology 99, 229-239
