AG Lochnit - Glykosphingolipide von Nematoden
Für die Charakterisierung und Strukturanalyse der Glykosphingolipide aus Nematoden entwickelten wir ein Trennungsprotokoll und chemische Methoden zur vorläufigen Bestimmung der amphoteren Glykosphingolipide [1], wobei wir A. suum als Modellorganismus verwendeten. Die Trennung ergab das Vorhandensein von neutralen, amphoteren und sauren Glycosphingolipiden. Da wir davon ausgingen, dass die amphoteren Glycosphingolipide in Bezug auf ihr Kohlenhydratgerüst den neutralen Strukturen entsprechen, haben wir diese Glycolipide zuerst strukturell aufgeklärt.
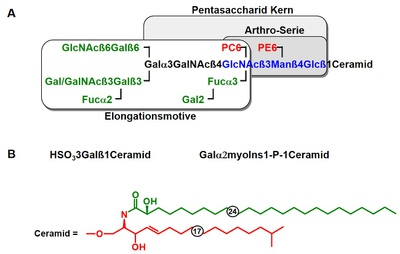
Nach Abtrennung der sauren Glycosphingolipide von der neutralen Fraktion durch Anionenaustauschchromatographie konnten wir die neutrale Fraktion durch Kieselgelchromatographie in eine neutrale und eine neutral-zwitterionische Fraktion unterteilen [2,3]. Die Trennung der neutralen Fraktion durch Hochleistungsflüssigkeitschromatographie (HPLC) ergab das Vorhandensein von Ceramid-Mono-, Di-, Tri- und Pentahexosiden. Die Kohlenhydratstrukturen wurden durch matrixunterstützte Laser-Desorptions-Ionisations-Flugzeit-Massenspektrometrie (MALDI-TOF-MS), Analyse der Kohlenhydratzusammensetzung, Flüssig-Sekundärionen-Massenspektrometrie (LSIMS), magnetische Kernresonanzspektroskopie (NMR), Gas-Flüssig-Chromatographie-Massenspektrometrie (GLC/MS), Methylierungsanalyse und sequenzielle Exoglycosidase-Behandlungen aufgeklärt. Die Ergebnisse zeigten, dass die Kohlenhydratstrukturen auf der so genannten Arthro-Reihe basieren, die zuvor für die Insekten C. vicina und Lucilia caesar beschrieben worden war [4-6]. Die vier aufgeklärten Glykosphingolipide spiegeln einen Biosyntheseweg mit dem Pentasaccharid Gala1-3GalNAcß1-4GlcNAcß1-3Manß1-4Glc als komplexeste Struktur wider (siehe Abb. 7). Nicht nur das Kohlenhydratgerüst, sondern auch der Ceramidanteil der neutralen Glycosphingolipide aus A. suum wies bemerkenswerte Besonderheiten auf. Es wurde festgestellt, dass Cerebronsäure (C24h:0) die dominierende Fettsäure ist, während die Sphingoid-Basen aus isoverzweigtem C17-Sphingosin, Sphinganin und Phytosphingosin bestehen.
Bildrechte: privat
Bei unserer ersten Charakterisierung der amphoteren Glykosphingolipide konnten wir bereits zeigen, dass diese Fraktion aus zwei Hauptkomponenten (Komponenten A und C) und mehreren Nebenkomponenten besteht [1]. Beide Hauptkomponenten enthielten Phosphat und Cholin, letzteres auch eine freie Aminogruppe. Mittels Kieselgelsäulenchromatographie konnten wir die Komponenten A und C sowie zwei Fraktionen, B1 und B2, isolieren, die aus Mischungen von Nebenverbindungen bestehen [7]. Die HPTLC-Immunfärbung mit einem Phosphorylcholin-spezifischen Antikörper zeigte bei allen Fraktionen eine positive Reaktion, während die HF-Behandlung die Immunreaktivität aufhob. Außerdem führte die HF-Behandlung der Komponenten A und C zu einem einzigen Glykosphingolipid mit ähnlichen Migrationseigenschaften wie das Ceramid-Pentahexosid aus der neutralen Fraktion. Da die Färbung für Aminogruppen nach der HF-Behandlung ebenfalls negativ ausfiel, schlossen wir daraus, dass die Komponente C einen weiteren phosphatgebundenen Substituenten enthielt, höchstwahrscheinlich Ethanolamin. Dies konnte durch seine Identifizierung als 9-Fluorenyl-Methoxycarbonyl-Derivat bestätigt werden. Cholin wurde nach Derivatisierung mit Pentafluorpropionsäureanhydrid und LSIMS-Analyse weiter identifiziert. In Übereinstimmung mit diesen Daten ergab die Analyse der Kohlenhydratzusammensetzung das Vorhandensein von Glc, Gal und GalNAc für beide Komponenten und zusätzlich Man für Komponente A. Nach HF-Behandlung wurde GlcNAc als zusätzlicher Monosaccharidrest in beiden Verbindungen gefunden. Aufgrund seiner Labilität unter stark alkalischen Bedingungen wurde der Phosphorylethanolamin (PE)-Substituent bei der Permethylierung eliminiert, was zu ähnlichen Methylierungsanalysedaten für beide Komponenten führte. Dies bestätigte die Pentasaccharid-Kernstruktur der neutralen Fraktion sowohl für die Komponente A als auch für die Komponente C. Der GlcNAc-Rest wurde jedoch erst nach der HF-Behandlung nachgewiesen, was die Lokalisierung des PC-Substituenten an diesem Monosaccharid-Rest ermöglicht. Ein Methylierungsschritt, bei dem PE in PC umgewandelt wurde, und eine anschließende Methylierungsanalyse ermöglichten die Zuordnung des PE-Substituenten zum Man-Rest. Für die genaue Lokalisierung der Substitutionspositionen wurden HF-Behandlungen entweder vor oder nach dem Permethylierungsschritt durchgeführt und zeigten, dass die amphoteren Substituenten PC und PE an C6 von GlcNAc bzw. C6 von Man gebunden waren. Diese Strukturdaten konnten durch NMR weiter bestätigt werden. Komponente C war das erste Glycosphingolipid, das zwei zwitterionische Substituenten trug. Massenspektrometrische Analysen zeigten ein charakteristisches Fragmentierungsverhalten dieser Glycosphingolipide im MALDI-TOF-MS aufgrund des Verlusts der Trimethylamingruppe des Cholins und der Bildung eines zyklischen Phosphotriesters im Fall von Komponente A und des Verlusts von Ethanolamin im Fall von Komponente C. Dieses Fragmentierungsmuster kann daher als Fingerabdruck zur Identifizierung der mit diesen zwitterionischen Substituenten substituierten Moleküle betrachtet werden.
Literatur:
[1] Dennis RD, Lochnit G, Geyer R. Strategies for preliminary characterization of novel amphoteric glycosphingolipids. Methods Mol Biol 1998;76:197-212.
[2] Lochnit G, Dennis RD, Zähringer U, Geyer R. Structural analysis of neutral glycosphingolipids from Ascaris suum adults (Nematoda: Ascaridida). Glycoconj J 1997;14:389-99.
[3] Sugita M, Mizunoma T, Hayata C, Hori T, Nakatani F, Aoki K. Classification into arthro-series of neutral glycosphingolipids from porcine roundworm, Ascaris suum, (Aschelminthes, Nematoda) [in Japanese]. J. Jpn. Oil Chem. Soc. 1994;43:495-501.
[4] Dennis RD, Geyer R, Egge H, Menges H, Stirm S, Weigandt H. Glycosphingolipids in insects. Chemical structures of ceramide monosaccharide, disaccharide and trisaccharide from pupae of Calliphora vicina (Insecta: Diptera). Eur J Biochem 1985;146:51-8.
[5] Dennis RD, Geyer R, Egge H, Peter-Katalinic J, Li SC, Stirm S, Wiegandt H. Glycosphingolipids in insects. Chemical structures of ceramide tetra-, penta-, hexa- and heptasaccharides from Calliphora vicina pupae. (Insecta: Diptera). J Biol Chem 1985;260:5370-5.
[6] Hori T, Sugita M. Sphingolipids in lower animals. Prog Lipid Res 1993;32:25-45.
[7] Lochnit G, Dennis RD, Ulmer AJ, Geyer R. Structural elucidation and monokine-inducing activity of two biologically active zwitterionic glycosphingolipids derived from the porcine parasitic nematode Ascaris suum. J Biol Chem 1998;278:466-74.
